摘要:Shah團隊開展NEDD4L介導GSDMD/GSDME泛素化降解研究。
當細胞遭遇病原體入侵或危險信號時,會啟動一種名為細胞焦亡(pyroptosis)的防御機制。這種細胞死亡方式猶如細胞的"自爆程序",通過細胞膜上形成孔洞釋放炎癥因子,向免疫系統(tǒng)發(fā)出警報。Gasdermin家族蛋白是執(zhí)行這一過程的關(guān)鍵"開關(guān)",其中Gasdermin D(GSDMD)和Gasdermin E(GSDME)最受關(guān)注。它們通常以休眠狀態(tài)存在,一旦被caspase蛋白酶切割,其N端片段就會在膜上寡聚化形成孔洞,引發(fā)炎癥反應。
然而,這種強大的防御機制如同一把雙刃劍。如果Gasdermin蛋白的活性失控,過度的細胞焦亡會導致組織損傷和慢性炎癥,進而引發(fā)心血管疾病、癌癥等多種疾病。因此,細胞必須擁有精細的調(diào)控機制來平衡Gasdermin蛋白的活性。近年來研究發(fā)現(xiàn),除了蛋白水解激活外,泛素化等翻譯后修飾在調(diào)控Gasdermin蛋白功能中扮演著重要角色。特別有趣的是,不同的E3泛素連接酶對Gasdermin蛋白施加著截然相反的影響:有的促進其功能,有的則抑制其活性。

圖1 NEDD4作為焦亡斗士平息炎癥:NEDD4L通過泛素化Gasdermin D與Gasdermin E抑制細胞焦亡
在這種復雜的調(diào)控網(wǎng)絡中,NEDD4L作為HECT家族E3連接酶的代表,其作用機制尤為引人注目。早期研究表明NEDD4L缺失會導致多器官功能障礙,但其具體分子機制尚未明確。同時,臨床發(fā)現(xiàn)人類NEDD4L基因變異與高血壓、終末期腎病等疾病相關(guān),暗示其可能在炎癥調(diào)控中發(fā)揮關(guān)鍵作用。這些線索促使研究人員深入探索NEDD4L是否通過調(diào)控Gasdermin蛋白來影響炎癥反應。
為回答這一科學問題,研究人員在《Cell Death and Differentiation》上發(fā)表了最新研究成果。他們采用基因敲除小鼠模型,結(jié)合細胞生物學和生物化學技術(shù),系統(tǒng)闡明了NEDD4L對GSDMD和GSDME的泛素化調(diào)控機制。研究發(fā)現(xiàn)Nedd4l基因敲除小鼠的肺泡上皮中GSDMD水平顯著升高,腎小管上皮中GSDME積累,提示NEDD4L具有組織特異性調(diào)控功能。在細胞水平,NEDD4L缺陷細胞對NLRP3激動劑、細胞毒性藥物和細菌感染更加敏感,表現(xiàn)出更強的細胞焦亡和IL-1β釋放。
機制研究表明,NEDD4L能夠直接結(jié)合并泛素化GSDMD和GSDME,通過蛋白酶體途徑促進其降解。特別重要的是,研究人員精確鑒定了泛素化位點:GSDMD N端片段上的K51、K203和K204位點,以及GSDME N端結(jié)構(gòu)域的K39、K40、K120位點和C端結(jié)構(gòu)域的K440位點。這一發(fā)現(xiàn)揭示了細胞通過負反饋機制防止過度炎癥反應的新途徑。
研究的關(guān)鍵技術(shù)方法主要包括:利用NEDD4L基因敲除小鼠模型進行組織特異性表達分析;通過體外泛素化實驗鑒定E3連接酶與底物的相互作用;采用位點特異性突變技術(shù)確定關(guān)鍵泛素化位點;使用NLRP3炎癥小體激活劑和細菌感染模型評估細胞焦亡表型。
NEDD4L缺失加劇Gasdermin介導的細胞死亡
研究表明NEDD4L缺陷細胞在受到NLRP3激動劑、細胞毒性藥物和細菌感染刺激時,表現(xiàn)出顯著增強的GSDMD和GSDME激活,導致細胞死亡增加和IL-1β釋放升高,證實NEDD4L在抑制Gasdermin蛋白活性中起關(guān)鍵作用。
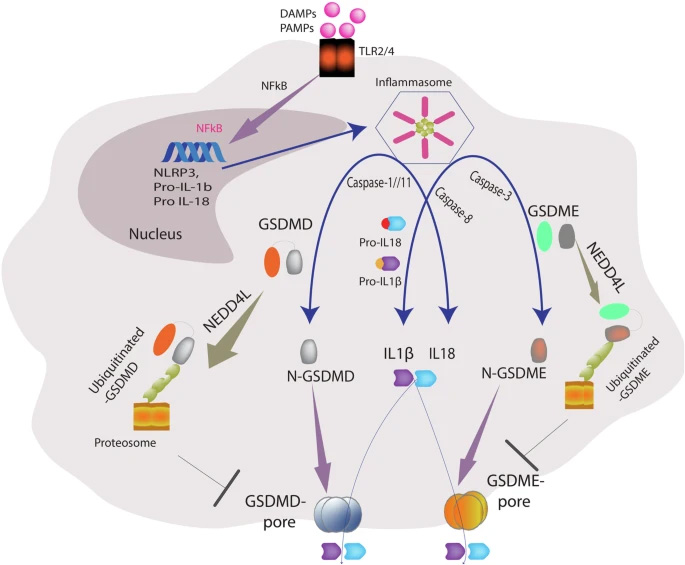
圖2 NEDD4L通過泛素化GSDMD與GSDME調(diào)控細胞焦亡
NEDD4L直接泛素化GSDMD和GSDME
生化實驗證明NEDD4L與GSDMD/GSDME發(fā)生直接相互作用,催化其發(fā)生K48連接的多聚泛素化修飾,從而靶向蛋白酶體降解途徑,而非通過非降解性泛素化修飾調(diào)控其功能。
組織特異性調(diào)控模式的發(fā)現(xiàn)
對NEDD4L敲除小鼠的分析顯示,GSDMD在肺泡上皮細胞中特異性積累,而GSDME在腎小管上皮中顯著升高,表明NEDD4L對不同Gasdermin蛋白的調(diào)控具有組織特異性,這解釋了NEDD4L缺失導致多器官功能障礙的現(xiàn)象。
泛素化位點的精確鑒定
通過質(zhì)譜分析和位點突變實驗,研究人員成功確定了GSDMD和GSDME上的關(guān)鍵泛素化位點,這些位點的突變顯著影響NEDD4L介導的降解效率,為理解調(diào)控特異性提供了結(jié)構(gòu)基礎(chǔ)。
該研究最終得出結(jié)論:NEDD4L作為重要的負調(diào)控因子,通過泛素化-蛋白酶體途徑降解GSDMD和GSDME,建立了一道防止細胞焦亡過度激活的"分子剎車"。這一發(fā)現(xiàn)不僅解釋了NEDD4L缺失導致多器官炎癥損傷的機制,更重要的是為治療炎癥相關(guān)疾病提供了新的靶點。與促進GSDMD活性的SYVN1(RING E3連接酶)相比,NEDD4L代表了一種相反的調(diào)控力量,這種對立統(tǒng)一的調(diào)控模式體現(xiàn)了細胞炎癥反應的精細平衡。
研究的創(chuàng)新性在于首次揭示了NEDD4L對Gasdermin蛋白的直接降解作用,并精確闡明了其分子機制。這一發(fā)現(xiàn)為理解E3連接酶家族在細胞死亡調(diào)控中的功能多樣性提供了重要證據(jù),也為開發(fā)針對NEDD4L-Gasdermin軸的治療策略奠定了理論基礎(chǔ)。未來,通過調(diào)節(jié)NEDD4L活性來精確控制炎癥反應強度,可能為心血管疾病、自身免疫性疾病和癌癥等多種炎癥相關(guān)疾病帶來新的治療希望。
參考資料
[1] NEDD 4 Pyre-fighters to extinguish inflammation: NEDD4L ubiquitinates Gasdermin D and Gasdermin E to dampen pyroptosis
摘要:Shah團隊開展NEDD4L介導GSDMD/GSDME泛素化降解研究。
當細胞遭遇病原體入侵或危險信號時,會啟動一種名為細胞焦亡(pyroptosis)的防御機制。這種細胞死亡方式猶如細胞的"自爆程序",通過細胞膜上形成孔洞釋放炎癥因子,向免疫系統(tǒng)發(fā)出警報。Gasdermin家族蛋白是執(zhí)行這一過程的關(guān)鍵"開關(guān)",其中Gasdermin D(GSDMD)和Gasdermin E(GSDME)最受關(guān)注。它們通常以休眠狀態(tài)存在,一旦被caspase蛋白酶切割,其N端片段就會在膜上寡聚化形成孔洞,引發(fā)炎癥反應。
然而,這種強大的防御機制如同一把雙刃劍。如果Gasdermin蛋白的活性失控,過度的細胞焦亡會導致組織損傷和慢性炎癥,進而引發(fā)心血管疾病、癌癥等多種疾病。因此,細胞必須擁有精細的調(diào)控機制來平衡Gasdermin蛋白的活性。近年來研究發(fā)現(xiàn),除了蛋白水解激活外,泛素化等翻譯后修飾在調(diào)控Gasdermin蛋白功能中扮演著重要角色。特別有趣的是,不同的E3泛素連接酶對Gasdermin蛋白施加著截然相反的影響:有的促進其功能,有的則抑制其活性。

圖1 NEDD4作為焦亡斗士平息炎癥:NEDD4L通過泛素化Gasdermin D與Gasdermin E抑制細胞焦亡
在這種復雜的調(diào)控網(wǎng)絡中,NEDD4L作為HECT家族E3連接酶的代表,其作用機制尤為引人注目。早期研究表明NEDD4L缺失會導致多器官功能障礙,但其具體分子機制尚未明確。同時,臨床發(fā)現(xiàn)人類NEDD4L基因變異與高血壓、終末期腎病等疾病相關(guān),暗示其可能在炎癥調(diào)控中發(fā)揮關(guān)鍵作用。這些線索促使研究人員深入探索NEDD4L是否通過調(diào)控Gasdermin蛋白來影響炎癥反應。
為回答這一科學問題,研究人員在《Cell Death and Differentiation》上發(fā)表了最新研究成果。他們采用基因敲除小鼠模型,結(jié)合細胞生物學和生物化學技術(shù),系統(tǒng)闡明了NEDD4L對GSDMD和GSDME的泛素化調(diào)控機制。研究發(fā)現(xiàn)Nedd4l基因敲除小鼠的肺泡上皮中GSDMD水平顯著升高,腎小管上皮中GSDME積累,提示NEDD4L具有組織特異性調(diào)控功能。在細胞水平,NEDD4L缺陷細胞對NLRP3激動劑、細胞毒性藥物和細菌感染更加敏感,表現(xiàn)出更強的細胞焦亡和IL-1β釋放。
機制研究表明,NEDD4L能夠直接結(jié)合并泛素化GSDMD和GSDME,通過蛋白酶體途徑促進其降解。特別重要的是,研究人員精確鑒定了泛素化位點:GSDMD N端片段上的K51、K203和K204位點,以及GSDME N端結(jié)構(gòu)域的K39、K40、K120位點和C端結(jié)構(gòu)域的K440位點。這一發(fā)現(xiàn)揭示了細胞通過負反饋機制防止過度炎癥反應的新途徑。
研究的關(guān)鍵技術(shù)方法主要包括:利用NEDD4L基因敲除小鼠模型進行組織特異性表達分析;通過體外泛素化實驗鑒定E3連接酶與底物的相互作用;采用位點特異性突變技術(shù)確定關(guān)鍵泛素化位點;使用NLRP3炎癥小體激活劑和細菌感染模型評估細胞焦亡表型。
NEDD4L缺失加劇Gasdermin介導的細胞死亡
研究表明NEDD4L缺陷細胞在受到NLRP3激動劑、細胞毒性藥物和細菌感染刺激時,表現(xiàn)出顯著增強的GSDMD和GSDME激活,導致細胞死亡增加和IL-1β釋放升高,證實NEDD4L在抑制Gasdermin蛋白活性中起關(guān)鍵作用。

圖2 NEDD4L通過泛素化GSDMD與GSDME調(diào)控細胞焦亡
NEDD4L直接泛素化GSDMD和GSDME
生化實驗證明NEDD4L與GSDMD/GSDME發(fā)生直接相互作用,催化其發(fā)生K48連接的多聚泛素化修飾,從而靶向蛋白酶體降解途徑,而非通過非降解性泛素化修飾調(diào)控其功能。
組織特異性調(diào)控模式的發(fā)現(xiàn)
對NEDD4L敲除小鼠的分析顯示,GSDMD在肺泡上皮細胞中特異性積累,而GSDME在腎小管上皮中顯著升高,表明NEDD4L對不同Gasdermin蛋白的調(diào)控具有組織特異性,這解釋了NEDD4L缺失導致多器官功能障礙的現(xiàn)象。
泛素化位點的精確鑒定
通過質(zhì)譜分析和位點突變實驗,研究人員成功確定了GSDMD和GSDME上的關(guān)鍵泛素化位點,這些位點的突變顯著影響NEDD4L介導的降解效率,為理解調(diào)控特異性提供了結(jié)構(gòu)基礎(chǔ)。
該研究最終得出結(jié)論:NEDD4L作為重要的負調(diào)控因子,通過泛素化-蛋白酶體途徑降解GSDMD和GSDME,建立了一道防止細胞焦亡過度激活的"分子剎車"。這一發(fā)現(xiàn)不僅解釋了NEDD4L缺失導致多器官炎癥損傷的機制,更重要的是為治療炎癥相關(guān)疾病提供了新的靶點。與促進GSDMD活性的SYVN1(RING E3連接酶)相比,NEDD4L代表了一種相反的調(diào)控力量,這種對立統(tǒng)一的調(diào)控模式體現(xiàn)了細胞炎癥反應的精細平衡。
研究的創(chuàng)新性在于首次揭示了NEDD4L對Gasdermin蛋白的直接降解作用,并精確闡明了其分子機制。這一發(fā)現(xiàn)為理解E3連接酶家族在細胞死亡調(diào)控中的功能多樣性提供了重要證據(jù),也為開發(fā)針對NEDD4L-Gasdermin軸的治療策略奠定了理論基礎(chǔ)。未來,通過調(diào)節(jié)NEDD4L活性來精確控制炎癥反應強度,可能為心血管疾病、自身免疫性疾病和癌癥等多種炎癥相關(guān)疾病帶來新的治療希望。
參考資料
[1] NEDD 4 Pyre-fighters to extinguish inflammation: NEDD4L ubiquitinates Gasdermin D and Gasdermin E to dampen pyroptosis



