摘要:研究人員近日剖析了高脂飲食誘發(fā)肝癌的潛在機(jī)制。
高脂飲食會(huì)引發(fā)肝臟炎癥和脂肪堆積,形成脂肪性肝病。這種疾病亦可由長期代謝應(yīng)激(如大量飲酒)誘發(fā),最終導(dǎo)致肝硬化、肝功能衰竭甚至癌癥。
麻省理工學(xué)院等機(jī)構(gòu)的研究人員近日剖析了高脂飲食誘發(fā)肝癌的潛在機(jī)制,并在《Cell》雜志上發(fā)表了研究成果。
他們發(fā)現(xiàn),面對高脂飲食刺激時(shí),肝臟中的成熟肝細(xì)胞會(huì)逆轉(zhuǎn)至未成熟的干細(xì)胞樣狀態(tài)。盡管這有助于細(xì)胞在高脂飲食造成的應(yīng)激環(huán)境中存活,但長期來看卻增加了細(xì)胞癌變的風(fēng)險(xiǎn)。
共同通訊作者、麻省理工學(xué)院的Alex K. Shalek教授指出:“當(dāng)細(xì)胞反復(fù)承受高脂飲食等應(yīng)激因素時(shí),它們會(huì)采取自保措施,但代價(jià)是增加腫瘤發(fā)生的風(fēng)險(xiǎn)?!?/div>
圖1 肝臟對慢性代謝應(yīng)激的適應(yīng)性改變是腫瘤發(fā)生的先兆

圖1 肝臟對慢性代謝應(yīng)激的適應(yīng)性改變是腫瘤發(fā)生的先兆
在這項(xiàng)新研究中,研究團(tuán)隊(duì)試圖揭示肝臟在應(yīng)對長期應(yīng)激時(shí)哪些基因被開啟或關(guān)閉。
為此,他們讓小鼠攝入高脂飲食,并在肝臟疾病發(fā)展的關(guān)鍵時(shí)間點(diǎn)對肝細(xì)胞進(jìn)行單細(xì)胞RNA測序。他們監(jiān)測了小鼠從肝炎發(fā)展到肝硬化、最終演變?yōu)榘┌Y過程中的基因表達(dá)變化。
在疾病發(fā)展的早期階段,研究人員發(fā)現(xiàn)高脂飲食促使肝細(xì)胞激活了一些基因,使其抵抗凋亡并促進(jìn)增殖。與此同時(shí),這些細(xì)胞開始關(guān)閉一些對正常功能至關(guān)重要的基因,包括代謝酶和分泌蛋白。
共同第一作者、麻省理工學(xué)院的Constantine Tzouanas表示:“這確實(shí)像是一種妥協(xié),優(yōu)先保障單個(gè)細(xì)胞在應(yīng)激環(huán)境中的生存,卻犧牲了整體組織的功能?!?/div>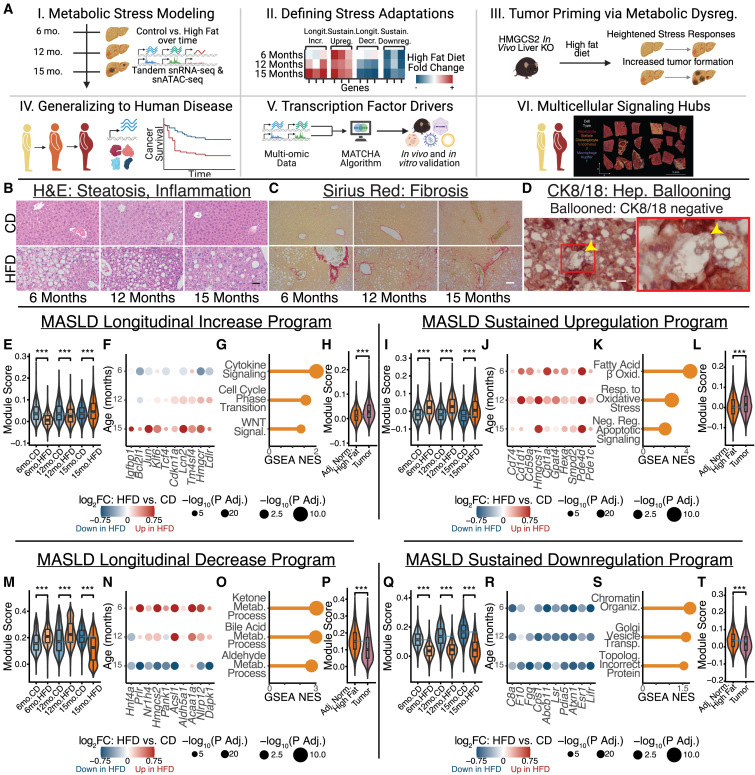
圖2 肝細(xì)胞對慢性代謝應(yīng)激的動(dòng)態(tài)應(yīng)答

圖1 肝臟對慢性代謝應(yīng)激的適應(yīng)性改變是腫瘤發(fā)生的先兆
一些變化立即發(fā)生,而另一些變化(包括代謝酶下降)則在更長時(shí)間內(nèi)逐步發(fā)生。當(dāng)研究接近尾聲時(shí),幾乎所有高脂飲食的小鼠都患上了肝癌。
研究人員指出,當(dāng)細(xì)胞處于未成熟的狀態(tài)時(shí),若后續(xù)發(fā)生突變,則癌變風(fēng)險(xiǎn)似乎更高。
“這些細(xì)胞脫離了本應(yīng)抑制其增殖能力的成熟狀態(tài)。一旦細(xì)胞獲得錯(cuò)誤突變,便會(huì)加速癌變進(jìn)程,它們在某些癌癥標(biāo)志物上已占據(jù)先機(jī),” Tzouanas解釋說。
研究人員還鑒定出一些基因,可調(diào)控肝細(xì)胞逆轉(zhuǎn)至未成熟狀態(tài)。研究期間,靶向其中一種基因(甲狀腺激素受體)的藥物獲批用于治療代謝功能障礙相關(guān)脂肪性肝炎(MASH)。

圖2 肝細(xì)胞對慢性代謝應(yīng)激的動(dòng)態(tài)應(yīng)答
他們還發(fā)現(xiàn)酮生成限速酶HMGCS2在此過程中下降,而激活該酶的藥物目前正處于治療脂肪性肝病的臨床試驗(yàn)階段。新研究發(fā)現(xiàn)的另一潛在靶點(diǎn)是SOX4轉(zhuǎn)錄因子,它通常在胎兒發(fā)育期及少數(shù)成人組織中激活。
在小鼠身上發(fā)現(xiàn)這些變化后,研究人員試圖探究人類肝病患者是否存在類似現(xiàn)象。他們分析了不同階段患者的肝臟組織樣本的數(shù)據(jù),還檢測了患有肝病但尚未發(fā)展為癌癥的患者組織。
研究結(jié)果顯示出與小鼠實(shí)驗(yàn)相似的模式:維持正常肝臟功能所需基因的表達(dá)逐步下降,而與未成熟狀態(tài)相關(guān)的基因表達(dá)則逐步上升。此外,他們還發(fā)現(xiàn),通過分析基因表達(dá)模式,能夠準(zhǔn)確預(yù)測患者的生存結(jié)局。
“高脂飲食激活的促細(xì)胞生存的基因表達(dá)水平較高的患者,在腫瘤形成后生存期較短,” Tzouanas指出?!爸С指闻K正常功能的基因表達(dá)水平較低的患者,生存期同樣較短?!?/div>
盡管本研究中的小鼠在一年左右就患上了癌癥,但研究人員估計(jì),對人類而言這一過程可能需要更長時(shí)間,大約20年左右。具體時(shí)間因人而異,取決于飲食及其他風(fēng)險(xiǎn)因素,如飲酒或病毒感染,這些因素也會(huì)促使肝細(xì)胞逆轉(zhuǎn)至未成熟狀態(tài)。
下一步,研究人員計(jì)劃探究,高脂飲食誘發(fā)的改變是否能通過恢復(fù)正常飲食或服用減肥藥物(如GLP-1激動(dòng)劑)來逆轉(zhuǎn)。他們還打算驗(yàn)證此次鑒定出的轉(zhuǎn)錄因子是否可作為藥物靶點(diǎn),阻止病變的肝臟組織發(fā)生癌變。
參考資料
[1] Hepatic adaptation to chronic metabolic stress primes tumorigenesis
摘要:研究人員近日剖析了高脂飲食誘發(fā)肝癌的潛在機(jī)制。

高脂飲食會(huì)引發(fā)肝臟炎癥和脂肪堆積,形成脂肪性肝病。這種疾病亦可由長期代謝應(yīng)激(如大量飲酒)誘發(fā),最終導(dǎo)致肝硬化、肝功能衰竭甚至癌癥。
麻省理工學(xué)院等機(jī)構(gòu)的研究人員近日剖析了高脂飲食誘發(fā)肝癌的潛在機(jī)制,并在《Cell》雜志上發(fā)表了研究成果。
他們發(fā)現(xiàn),面對高脂飲食刺激時(shí),肝臟中的成熟肝細(xì)胞會(huì)逆轉(zhuǎn)至未成熟的干細(xì)胞樣狀態(tài)。盡管這有助于細(xì)胞在高脂飲食造成的應(yīng)激環(huán)境中存活,但長期來看卻增加了細(xì)胞癌變的風(fēng)險(xiǎn)。
共同通訊作者、麻省理工學(xué)院的Alex K. Shalek教授指出:“當(dāng)細(xì)胞反復(fù)承受高脂飲食等應(yīng)激因素時(shí),它們會(huì)采取自保措施,但代價(jià)是增加腫瘤發(fā)生的風(fēng)險(xiǎn)。”

圖1 肝臟對慢性代謝應(yīng)激的適應(yīng)性改變是腫瘤發(fā)生的先兆
在這項(xiàng)新研究中,研究團(tuán)隊(duì)試圖揭示肝臟在應(yīng)對長期應(yīng)激時(shí)哪些基因被開啟或關(guān)閉。
為此,他們讓小鼠攝入高脂飲食,并在肝臟疾病發(fā)展的關(guān)鍵時(shí)間點(diǎn)對肝細(xì)胞進(jìn)行單細(xì)胞RNA測序。他們監(jiān)測了小鼠從肝炎發(fā)展到肝硬化、最終演變?yōu)榘┌Y過程中的基因表達(dá)變化。
在疾病發(fā)展的早期階段,研究人員發(fā)現(xiàn)高脂飲食促使肝細(xì)胞激活了一些基因,使其抵抗凋亡并促進(jìn)增殖。與此同時(shí),這些細(xì)胞開始關(guān)閉一些對正常功能至關(guān)重要的基因,包括代謝酶和分泌蛋白。
共同第一作者、麻省理工學(xué)院的Constantine Tzouanas表示:“這確實(shí)像是一種妥協(xié),優(yōu)先保障單個(gè)細(xì)胞在應(yīng)激環(huán)境中的生存,卻犧牲了整體組織的功能?!?/div>
圖2 肝細(xì)胞對慢性代謝應(yīng)激的動(dòng)態(tài)應(yīng)答
一些變化立即發(fā)生,而另一些變化(包括代謝酶下降)則在更長時(shí)間內(nèi)逐步發(fā)生。當(dāng)研究接近尾聲時(shí),幾乎所有高脂飲食的小鼠都患上了肝癌。
研究人員指出,當(dāng)細(xì)胞處于未成熟的狀態(tài)時(shí),若后續(xù)發(fā)生突變,則癌變風(fēng)險(xiǎn)似乎更高。
“這些細(xì)胞脫離了本應(yīng)抑制其增殖能力的成熟狀態(tài)。一旦細(xì)胞獲得錯(cuò)誤突變,便會(huì)加速癌變進(jìn)程,它們在某些癌癥標(biāo)志物上已占據(jù)先機(jī),” Tzouanas解釋說。
研究人員還鑒定出一些基因,可調(diào)控肝細(xì)胞逆轉(zhuǎn)至未成熟狀態(tài)。研究期間,靶向其中一種基因(甲狀腺激素受體)的藥物獲批用于治療代謝功能障礙相關(guān)脂肪性肝炎(MASH)。

圖2 肝細(xì)胞對慢性代謝應(yīng)激的動(dòng)態(tài)應(yīng)答
他們還發(fā)現(xiàn)酮生成限速酶HMGCS2在此過程中下降,而激活該酶的藥物目前正處于治療脂肪性肝病的臨床試驗(yàn)階段。新研究發(fā)現(xiàn)的另一潛在靶點(diǎn)是SOX4轉(zhuǎn)錄因子,它通常在胎兒發(fā)育期及少數(shù)成人組織中激活。
在小鼠身上發(fā)現(xiàn)這些變化后,研究人員試圖探究人類肝病患者是否存在類似現(xiàn)象。他們分析了不同階段患者的肝臟組織樣本的數(shù)據(jù),還檢測了患有肝病但尚未發(fā)展為癌癥的患者組織。
研究結(jié)果顯示出與小鼠實(shí)驗(yàn)相似的模式:維持正常肝臟功能所需基因的表達(dá)逐步下降,而與未成熟狀態(tài)相關(guān)的基因表達(dá)則逐步上升。此外,他們還發(fā)現(xiàn),通過分析基因表達(dá)模式,能夠準(zhǔn)確預(yù)測患者的生存結(jié)局。
“高脂飲食激活的促細(xì)胞生存的基因表達(dá)水平較高的患者,在腫瘤形成后生存期較短,” Tzouanas指出。“支持肝臟正常功能的基因表達(dá)水平較低的患者,生存期同樣較短?!?/div>
盡管本研究中的小鼠在一年左右就患上了癌癥,但研究人員估計(jì),對人類而言這一過程可能需要更長時(shí)間,大約20年左右。具體時(shí)間因人而異,取決于飲食及其他風(fēng)險(xiǎn)因素,如飲酒或病毒感染,這些因素也會(huì)促使肝細(xì)胞逆轉(zhuǎn)至未成熟狀態(tài)。
下一步,研究人員計(jì)劃探究,高脂飲食誘發(fā)的改變是否能通過恢復(fù)正常飲食或服用減肥藥物(如GLP-1激動(dòng)劑)來逆轉(zhuǎn)。他們還打算驗(yàn)證此次鑒定出的轉(zhuǎn)錄因子是否可作為藥物靶點(diǎn),阻止病變的肝臟組織發(fā)生癌變。
參考資料
[1] Hepatic adaptation to chronic metabolic stress primes tumorigenesis



