摘要:本文推薦通過高強度聚焦超聲(HIFU)聯(lián)合生物信息學篩選與血小板膜雜交脂質(zhì)體遞送系統(tǒng),實現(xiàn)基底樣乳腺癌(BLBC)的靶向細胞焦亡治療。
基底樣乳腺癌(BLBC)作為最具侵襲性的乳腺癌亞型,因其高度異質(zhì)性和缺乏有效治療靶點而面臨治療困境。細胞焦亡作為一種炎性程序性細胞死亡方式,通過膜穿孔和炎癥因子釋放重塑腫瘤微環(huán)境,為BLBC治療提供了新方向。高強度聚焦超聲(HIFU)作為非侵入性物理治療手段,不僅能直接消融腫瘤,還可增強藥物遞送效率和免疫應答,但其與細胞焦亡的協(xié)同機制尚未明確。
關(guān)鍵焦亡相關(guān)基因與藥物篩選:通過對TCGA數(shù)據(jù)庫中169例BLBC樣本的生物信息學分析,鑒定出28個關(guān)鍵焦亡相關(guān)基因(包括AIM2、GSDMC、NLRP3等)。生存分析顯示這些基因與患者復發(fā)風險顯著相關(guān)(p<0.0001)。結(jié)合ctd和cellminer數(shù)據(jù)庫篩選出94種潛在焦亡誘導劑,其中米托蒽醌(mit)經(jīng)實驗驗證與hifu協(xié)同作用最強,使4t1細胞ic50值降低12.91倍。hifu照射(8.4w,30秒)顯著改變20個焦亡基因表達,通過hifu-基因-藥物互作網(wǎng)絡鎖定20個候選誘導劑。< div="">
圖1 HIFU驅(qū)動靶向細胞焦亡療法治療基底細胞樣乳腺癌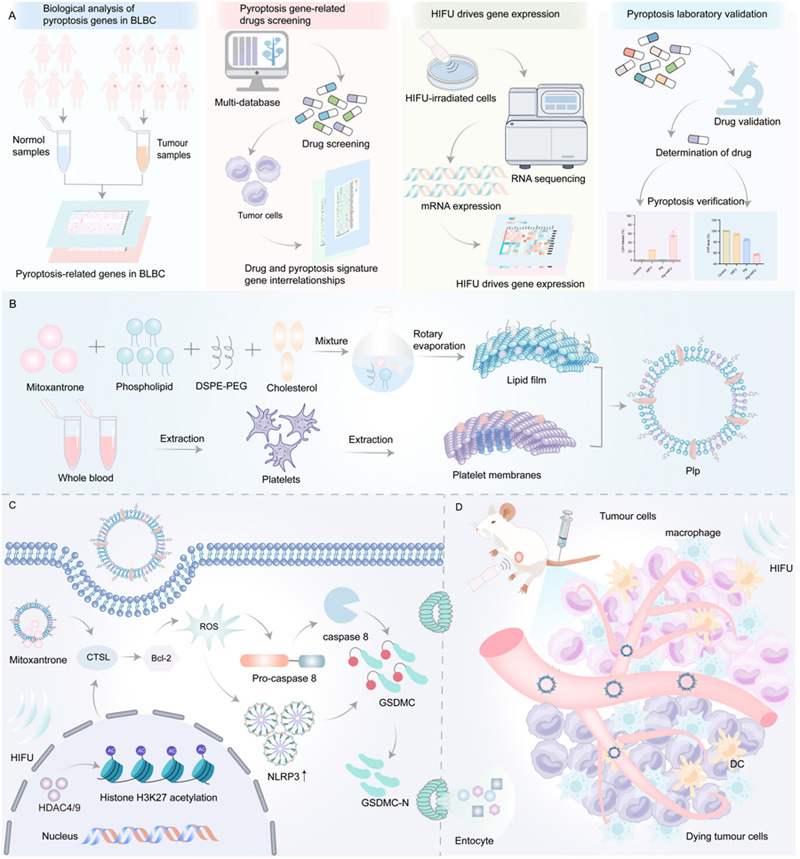
圖2 闡述了細胞焦亡誘導劑的篩選及其與HIFU聯(lián)合治療BLBC的作用機制研究

圖1 HIFU驅(qū)動靶向細胞焦亡療法治療基底細胞樣乳腺癌
Plp構(gòu)建與表征:采用薄膜水化-擠出法制備血小板膜雜交脂質(zhì)體(Plp),其粒徑為114.3±3.84 nm,zeta電位-1.00±0.02 mV,載藥量8.07±0.01%,包封率94.78±0.19%。冷凍電鏡顯示Plp呈囊泡狀結(jié)構(gòu),穩(wěn)定性良好。血小板膜表面的P-選擇素通過CD44受體介導腫瘤靶向,使Plp的細胞攝取效率較普通脂質(zhì)體(Lip)提高1.34倍。HIFU處理進一步使Plp的腫瘤遞送效率提升2.78倍。
機制研究:HIFU通過機械應力下調(diào)IIa類組蛋白去乙?;窰DAC4和HDAC9表達,導致組蛋白H3K27乙?;℉3K27Ac)水平顯著升高,開放染色質(zhì)結(jié)構(gòu)并促進CTSL基因轉(zhuǎn)錄。Plp與HIFU協(xié)同抑制BCL-2表達,誘導線粒體膜電位下降和活性氧(ROS)爆發(fā)(Plp+HIFU組ROS水平為對照組的1.53倍)。過量ROS激活caspase-8和NLRP3炎癥小體,切割Gasdermin C(GSDMC)產(chǎn)生N端片段(GSDMC-N),形成細胞膜孔道引發(fā)焦亡。siRNA敲低CTSL證實該基因在GSDMC切割中的關(guān)鍵作用。
轉(zhuǎn)錄組學驗證:RNA測序顯示Plp+HIFU處理組有3784個基因上調(diào),1221個基因下調(diào)。GSEA分析證實焦亡通路富集(富集分數(shù)0.46),KEGG分析顯示細胞因子-細胞因子受體相互作用和鈣信號通路激活。雷達圖顯示IL-6、GSDMC和AIM2表達分別上調(diào)2.34、2.08和3.46倍。ROS相關(guān)基因表達譜改變(29個上調(diào),12個下調(diào))支持氧化應激在焦亡中的核心地位。
體內(nèi)療效評估:Plp+HIFU組腫瘤抑制率達94.04%,50%小鼠實現(xiàn)腫瘤完全消退?;铙w熒光成像顯示Plp在腫瘤部位富集強度為Lip組的2.03倍,聯(lián)合HIFU后進一步提升1.59倍。藥代動力學顯示Plp血藥濃度在8h時為Lip組的1.82倍。H&E和TUNEL染色顯示顯著腫瘤壞死,Ki67表達抑制。免疫組化證實caspase-8、GSDMC-N和H3K27Ac表達上調(diào),HDAC4下調(diào)。

圖2 闡述了細胞焦亡誘導劑的篩選及其與HIFU聯(lián)合治療BLBC的作用機制研究
免疫調(diào)控效應:Plp+HIFU處理促進樹突狀細胞成熟(腫瘤內(nèi)CD80+CD86+ DCs增加1.78倍),CD8+ T細胞浸潤增強1.78倍。脾臟中央記憶T細胞(CD44+CD62L+)比例顯著升高(CD8+ T細胞達46.63%)。腫瘤相關(guān)巨噬細胞向M1型極化(比例從17.13%增至31.7%),M2型巨噬細胞從19.13%降至4.06%。ELISA檢測顯示腫瘤微環(huán)境中IL-6和IFN-γ水平顯著升高。
結(jié)論:本研究構(gòu)建了HIFU驅(qū)動的精準焦亡治療新策略,通過多組學篩選發(fā)現(xiàn)MIT作為高效焦亡誘導劑,并創(chuàng)新性采用血小板膜雜交脂質(zhì)體增強靶向遞送。機制上揭示HIFU通過表觀遺傳調(diào)控HDAC4/9-H3K27Ac-CTSL軸,協(xié)同Plp激活ROS/caspase-8/NLRP3/GSDMC通路。該策略為BLBC及其他難治性腫瘤提供了物理-化學-免疫協(xié)同治療新模式。
參考資料
[1] HIFU-Driven Targeted Pyroptosis Therapy in Basal-Like Breast Cancer
摘要:本文推薦通過高強度聚焦超聲(HIFU)聯(lián)合生物信息學篩選與血小板膜雜交脂質(zhì)體遞送系統(tǒng),實現(xiàn)基底樣乳腺癌(BLBC)的靶向細胞焦亡治療。
基底樣乳腺癌(BLBC)作為最具侵襲性的乳腺癌亞型,因其高度異質(zhì)性和缺乏有效治療靶點而面臨治療困境。細胞焦亡作為一種炎性程序性細胞死亡方式,通過膜穿孔和炎癥因子釋放重塑腫瘤微環(huán)境,為BLBC治療提供了新方向。高強度聚焦超聲(HIFU)作為非侵入性物理治療手段,不僅能直接消融腫瘤,還可增強藥物遞送效率和免疫應答,但其與細胞焦亡的協(xié)同機制尚未明確。
關(guān)鍵焦亡相關(guān)基因與藥物篩選:通過對TCGA數(shù)據(jù)庫中169例BLBC樣本的生物信息學分析,鑒定出28個關(guān)鍵焦亡相關(guān)基因(包括AIM2、GSDMC、NLRP3等)。生存分析顯示這些基因與患者復發(fā)風險顯著相關(guān)(p<0.0001)。結(jié)合ctd和cellminer數(shù)據(jù)庫篩選出94種潛在焦亡誘導劑,其中米托蒽醌(mit)經(jīng)實驗驗證與hifu協(xié)同作用最強,使4t1細胞ic50值降低12.91倍。hifu照射(8.4w,30秒)顯著改變20個焦亡基因表達,通過hifu-基因-藥物互作網(wǎng)絡鎖定20個候選誘導劑。< div="">
圖1 HIFU驅(qū)動靶向細胞焦亡療法治療基底細胞樣乳腺癌
圖2 闡述了細胞焦亡誘導劑的篩選及其與HIFU聯(lián)合治療BLBC的作用機制研究

圖1 HIFU驅(qū)動靶向細胞焦亡療法治療基底細胞樣乳腺癌
Plp構(gòu)建與表征:采用薄膜水化-擠出法制備血小板膜雜交脂質(zhì)體(Plp),其粒徑為114.3±3.84 nm,zeta電位-1.00±0.02 mV,載藥量8.07±0.01%,包封率94.78±0.19%。冷凍電鏡顯示Plp呈囊泡狀結(jié)構(gòu),穩(wěn)定性良好。血小板膜表面的P-選擇素通過CD44受體介導腫瘤靶向,使Plp的細胞攝取效率較普通脂質(zhì)體(Lip)提高1.34倍。HIFU處理進一步使Plp的腫瘤遞送效率提升2.78倍。
機制研究:HIFU通過機械應力下調(diào)IIa類組蛋白去乙?;窰DAC4和HDAC9表達,導致組蛋白H3K27乙酰化(H3K27Ac)水平顯著升高,開放染色質(zhì)結(jié)構(gòu)并促進CTSL基因轉(zhuǎn)錄。Plp與HIFU協(xié)同抑制BCL-2表達,誘導線粒體膜電位下降和活性氧(ROS)爆發(fā)(Plp+HIFU組ROS水平為對照組的1.53倍)。過量ROS激活caspase-8和NLRP3炎癥小體,切割Gasdermin C(GSDMC)產(chǎn)生N端片段(GSDMC-N),形成細胞膜孔道引發(fā)焦亡。siRNA敲低CTSL證實該基因在GSDMC切割中的關(guān)鍵作用。
轉(zhuǎn)錄組學驗證:RNA測序顯示Plp+HIFU處理組有3784個基因上調(diào),1221個基因下調(diào)。GSEA分析證實焦亡通路富集(富集分數(shù)0.46),KEGG分析顯示細胞因子-細胞因子受體相互作用和鈣信號通路激活。雷達圖顯示IL-6、GSDMC和AIM2表達分別上調(diào)2.34、2.08和3.46倍。ROS相關(guān)基因表達譜改變(29個上調(diào),12個下調(diào))支持氧化應激在焦亡中的核心地位。
體內(nèi)療效評估:Plp+HIFU組腫瘤抑制率達94.04%,50%小鼠實現(xiàn)腫瘤完全消退?;铙w熒光成像顯示Plp在腫瘤部位富集強度為Lip組的2.03倍,聯(lián)合HIFU后進一步提升1.59倍。藥代動力學顯示Plp血藥濃度在8h時為Lip組的1.82倍。H&E和TUNEL染色顯示顯著腫瘤壞死,Ki67表達抑制。免疫組化證實caspase-8、GSDMC-N和H3K27Ac表達上調(diào),HDAC4下調(diào)。

圖2 闡述了細胞焦亡誘導劑的篩選及其與HIFU聯(lián)合治療BLBC的作用機制研究
免疫調(diào)控效應:Plp+HIFU處理促進樹突狀細胞成熟(腫瘤內(nèi)CD80+CD86+ DCs增加1.78倍),CD8+ T細胞浸潤增強1.78倍。脾臟中央記憶T細胞(CD44+CD62L+)比例顯著升高(CD8+ T細胞達46.63%)。腫瘤相關(guān)巨噬細胞向M1型極化(比例從17.13%增至31.7%),M2型巨噬細胞從19.13%降至4.06%。ELISA檢測顯示腫瘤微環(huán)境中IL-6和IFN-γ水平顯著升高。
結(jié)論:本研究構(gòu)建了HIFU驅(qū)動的精準焦亡治療新策略,通過多組學篩選發(fā)現(xiàn)MIT作為高效焦亡誘導劑,并創(chuàng)新性采用血小板膜雜交脂質(zhì)體增強靶向遞送。機制上揭示HIFU通過表觀遺傳調(diào)控HDAC4/9-H3K27Ac-CTSL軸,協(xié)同Plp激活ROS/caspase-8/NLRP3/GSDMC通路。該策略為BLBC及其他難治性腫瘤提供了物理-化學-免疫協(xié)同治療新模式。
參考資料
[1] HIFU-Driven Targeted Pyroptosis Therapy in Basal-Like Breast Cancer



