摘要:根據(jù)3月7日發(fā)表在公開期刊上的一項新研究,減少關(guān)鍵信使RNA的甲基化可以促進(jìn)巨噬細(xì)胞向大腦的遷移,并改善小鼠模型中阿爾茨海默病的癥狀。
中國陜西西安空軍醫(yī)科大學(xué)的Rui Zhang在3月7日發(fā)表在開放獲取期刊《PLOS Biology》上的一項新研究表明,減少關(guān)鍵信使RNA的甲基化可以促進(jìn)巨噬細(xì)胞向大腦的遷移,并改善小鼠模型中的阿爾茨海默病癥狀。該結(jié)果闡明了外周免疫細(xì)胞進(jìn)入大腦的一條途徑,并可能為治療阿爾茨海默病提供一個新的靶點。

圖1 研究表明減少關(guān)鍵信使RNA的甲基化可以促進(jìn)巨噬細(xì)胞向大腦的遷移(圖源:[1])
阿爾茨海默病發(fā)展的一個假定觸發(fā)因素是大腦中蛋白質(zhì)、細(xì)胞外淀粉樣β斑塊的積累。小鼠體內(nèi)高水平的β -淀粉樣蛋白會導(dǎo)致神經(jīng)退行性變和類似人類阿爾茨海默病的認(rèn)知癥狀,減少β -淀粉樣蛋白是開發(fā)新治療方法的主要目標(biāo)。
消除β淀粉樣蛋白的一個潛在途徑是血液來源的骨髓細(xì)胞遷移到大腦,并成熟為巨噬細(xì)胞,巨噬細(xì)胞與常駐的小膠質(zhì)細(xì)胞一起可以消耗β淀粉樣蛋白。這種遷移是一個復(fù)雜的現(xiàn)象,由多個相互作用的參與者控制,但一個潛在的重要因素是髓系細(xì)胞內(nèi)信使RNA的甲基化。
最常見的mRNA甲基化類型被稱為m6A,是由METTL3酶進(jìn)行的,因此作者首先詢問在阿爾茨海默病小鼠模型中,髓系細(xì)胞中METTL3的缺乏是否對認(rèn)知有任何影響。他們發(fā)現(xiàn),服用了該藥物的小鼠在各種認(rèn)知測試中表現(xiàn)得更好,當(dāng)它們阻止髓細(xì)胞向大腦的遷移時,這種效果可能會被抑制。
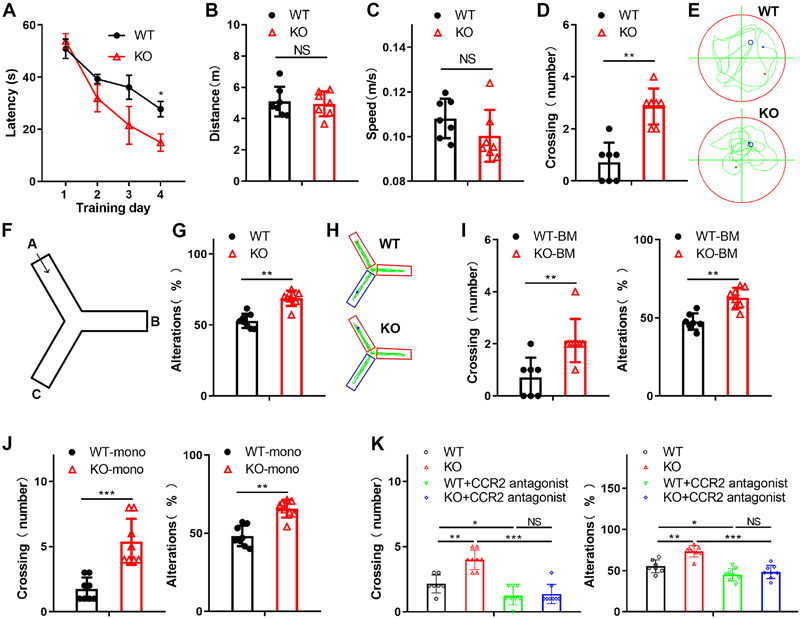
圖2 單核細(xì)胞衍生巨噬細(xì)胞METTL3缺乏可減輕Aβ誘導(dǎo)的AD癥狀(圖源:[1])
mRNA甲基化降低如何促進(jìn)髓細(xì)胞遷移?作者闡明了一種復(fù)雜的機(jī)制。通過分析mRNA表達(dá)模式和其他技術(shù),他們發(fā)現(xiàn)METTL3的缺失降低了一個關(guān)鍵m6A閱讀蛋白的活性,該蛋白可以識別m6A修飾的mRNA并促進(jìn)其翻譯成蛋白質(zhì)。這導(dǎo)致了另一種蛋白質(zhì)的下降,抑制了另一種叫做ATAT1的蛋白質(zhì)的產(chǎn)生。ATAT1的缺失減少了乙?;鶎ξ⒐艿母街?,而這種減少反過來促進(jìn)了髓細(xì)胞向大腦的遷移,隨后成熟為巨噬細(xì)胞,增加了淀粉樣蛋白的清除,并改善了小鼠的認(rèn)知能力。
“我們的研究結(jié)果表明,m6A修飾是治療阿爾茨海默病的潛在靶點,”作者總結(jié)道,同時指出,關(guān)于阿爾茨海默病的這種途徑還有很多有待探索。由于mRNA甲基化對廣泛的下游靶標(biāo)具有根本影響,因此在這一途徑中有效的藥物開發(fā)可能需要進(jìn)一步向下游移動以避免不必要的影響。
參考資料:
[1] Loss of the m6A methyltransferase METTL3 in monocyte-derived macrophages ameliorates Alzheimer’s disease pathology in mice
摘要:根據(jù)3月7日發(fā)表在公開期刊上的一項新研究,減少關(guān)鍵信使RNA的甲基化可以促進(jìn)巨噬細(xì)胞向大腦的遷移,并改善小鼠模型中阿爾茨海默病的癥狀。
中國陜西西安空軍醫(yī)科大學(xué)的Rui Zhang在3月7日發(fā)表在開放獲取期刊《PLOS Biology》上的一項新研究表明,減少關(guān)鍵信使RNA的甲基化可以促進(jìn)巨噬細(xì)胞向大腦的遷移,并改善小鼠模型中的阿爾茨海默病癥狀。該結(jié)果闡明了外周免疫細(xì)胞進(jìn)入大腦的一條途徑,并可能為治療阿爾茨海默病提供一個新的靶點。

圖1 研究表明減少關(guān)鍵信使RNA的甲基化可以促進(jìn)巨噬細(xì)胞向大腦的遷移(圖源:[1])
阿爾茨海默病發(fā)展的一個假定觸發(fā)因素是大腦中蛋白質(zhì)、細(xì)胞外淀粉樣β斑塊的積累。小鼠體內(nèi)高水平的β -淀粉樣蛋白會導(dǎo)致神經(jīng)退行性變和類似人類阿爾茨海默病的認(rèn)知癥狀,減少β -淀粉樣蛋白是開發(fā)新治療方法的主要目標(biāo)。
消除β淀粉樣蛋白的一個潛在途徑是血液來源的骨髓細(xì)胞遷移到大腦,并成熟為巨噬細(xì)胞,巨噬細(xì)胞與常駐的小膠質(zhì)細(xì)胞一起可以消耗β淀粉樣蛋白。這種遷移是一個復(fù)雜的現(xiàn)象,由多個相互作用的參與者控制,但一個潛在的重要因素是髓系細(xì)胞內(nèi)信使RNA的甲基化。
最常見的mRNA甲基化類型被稱為m6A,是由METTL3酶進(jìn)行的,因此作者首先詢問在阿爾茨海默病小鼠模型中,髓系細(xì)胞中METTL3的缺乏是否對認(rèn)知有任何影響。他們發(fā)現(xiàn),服用了該藥物的小鼠在各種認(rèn)知測試中表現(xiàn)得更好,當(dāng)它們阻止髓細(xì)胞向大腦的遷移時,這種效果可能會被抑制。

圖2 單核細(xì)胞衍生巨噬細(xì)胞METTL3缺乏可減輕Aβ誘導(dǎo)的AD癥狀(圖源:[1])
mRNA甲基化降低如何促進(jìn)髓細(xì)胞遷移?作者闡明了一種復(fù)雜的機(jī)制。通過分析mRNA表達(dá)模式和其他技術(shù),他們發(fā)現(xiàn)METTL3的缺失降低了一個關(guān)鍵m6A閱讀蛋白的活性,該蛋白可以識別m6A修飾的mRNA并促進(jìn)其翻譯成蛋白質(zhì)。這導(dǎo)致了另一種蛋白質(zhì)的下降,抑制了另一種叫做ATAT1的蛋白質(zhì)的產(chǎn)生。ATAT1的缺失減少了乙?;鶎ξ⒐艿母街@種減少反過來促進(jìn)了髓細(xì)胞向大腦的遷移,隨后成熟為巨噬細(xì)胞,增加了淀粉樣蛋白的清除,并改善了小鼠的認(rèn)知能力。
“我們的研究結(jié)果表明,m6A修飾是治療阿爾茨海默病的潛在靶點,”作者總結(jié)道,同時指出,關(guān)于阿爾茨海默病的這種途徑還有很多有待探索。由于mRNA甲基化對廣泛的下游靶標(biāo)具有根本影響,因此在這一途徑中有效的藥物開發(fā)可能需要進(jìn)一步向下游移動以避免不必要的影響。
參考資料:
[1] Loss of the m6A methyltransferase METTL3 in monocyte-derived macrophages ameliorates Alzheimer’s disease pathology in mice



